EL PAPEL #25 TÉCNICO
UNDERSTANDING LAS BATERÍAS
Por
Lee Merriman
los Críticos Técnicos
J.F.
Douglas
James H. Hahn
Lester H. Smith, Hijo,
Published Por
VITA
1600 Bulevar de Wilson, Colección 500,
Arlington, Virginia 22209 EE.UU.
TEL:
703/276-1800. El facsímil: 703/243-1865
Internet:
pr-info@vita.org
Understanding las Baterías
ISBN:
0-86619-225-5
[C]1985, Voluntarios en la Ayuda Técnica,
PREFACE
Este papel es uno de una serie publicado por Voluntarios en Técnico
La ayuda para proporcionar una introducción a específico innovador
las tecnologías de interés a las personas en los países en desarrollo.
Se piensa que los papeles son usados como las pautas para ayudar
las personas escogen tecnologías que son conveniente a sus situaciones.
No se piensa que ellos proporcionan construcción o aplicación
se instan a las Personas de details. que avisen VITA o una organización similar
para la información extensa y soporte técnica si ellos
hallazgo que una tecnología particular parece satisfacer sus necesidades.
Los papeles en las series eran escrito, repasaron, e ilustraron
casi completamente por VITA Volunteer los expertos técnicos en un puramente
basis. voluntario Unos 500 voluntarios estaban envueltos en la producción
de los primeros 100 títulos emitidos, mientras contribuyendo aproximadamente
5,000 horas de su time. el personal de VITA incluyó María Giannuzzi
como editor, Suzanne Brooks que se ocupa dado la composición y diseño, y
Margaret Crouch como gerente del proyecto.
El autor de este papel, VITA Horace McCracken Voluntario, es el
presidente del McCracken la Compañía Solar en Alturas, California.
El coautor, VITA Joël Gordes Voluntario, es actualmente el solar
diseñe a analista para el Estado de la Hipoteca Solar de Connecticut
El Subsidio Program. Los críticos también son VITA volunteers. Daniel
Dunham ha hecho consultando en las fuentes solares y alternativas de
la energía para VITA y AID. Él ha vivido y ha trabajado en India, Pakistán,
y Morocco. Sr. Dunham también ha preparado un innovador
inspeccione en los destiladores solares para la AYUDA.
Jacques Le Normand es Assistant
El Director en el Instituto de Investigación de Abrazadera, Quebec, Canadá,
qué investiga en la energía renovable.
Él ha dirigido el trabajo
con los coleccionistas solares y ha escrito varios publiations adelante
solar y energía del viento, y conservación.
Darrell G. Phippen es un
el ingeniero mecánico y especialista de desarrollo con que trabajan
La comida para el Hambriento en Scottsdale, Arizona.
VITA es un privado, empresa no ganancial que apoya a las personas
trabajando en los problemas técnicos en los países en desarrollo.
las ofertas de VITA
la información y ayuda apuntaron a ayudar a los individuos y
los grupos para seleccionar y las tecnologías del instrumento destinan a su
situations. VITA mantiene un Servicio de la Pregunta internacional, un
el centro de la documentación especializado, y una lista informatizada de
los consultores técnicos voluntarios; maneja los proyectos del campo a largo plazo;
y publica una variedad de manuales técnicos y papeles.
UNDERSTANDING LAS BATERÍAS
Por VITA Lee Merriman Voluntario
LA INTRODUCCIÓN DE I.
Las baterías han estado en el uso durante muchos años, pero hay hoy un
la demanda mayor para el poder de la batería que en la vida antes de.
que Esto renovó
el interés no sólo se ha provocado por los nuevos desarrollos pero
también por la diversidad de usos para las baterías en el paisano, industrial,
y las aplicaciones militares.
Este papel proporciona un entendiendo básico de baterías y rastros
su desarrollo de los tempranos 1800s a la Investigación de day. presente
y el desarrollo continúa en un esfuerzo para resolver el inherente
la debilidad de baterías, a saber, cómo condensar más energía
en un paquete menor.
Una célula eléctrica o la batería es un dispositivo que transforma el
la energía química contuvo directamente dentro de sus materiales activos
en la energía eléctrica por medio de una reacción electroquímica.
Este tipo de reacción involucra el traslado de electrones de uno
el material a otra a través de una solución dirigiendo.
Historically,
las baterías jugaron un papel importante en los días tempranos de eléctrico
el desarrollo ambos en los Estados Unidos y en Europa.
En 1800 un científico italiano nombrado que Volta descubrió eso por
los dos conductores disímil sumergiendo en una solución química un
la fuerza electromotriz (EMF) o el voltaje se estableció entre el
dos conductors. Figure 1 ilustra una célula Voltaica simple.
ub1x1.gif (393x393)
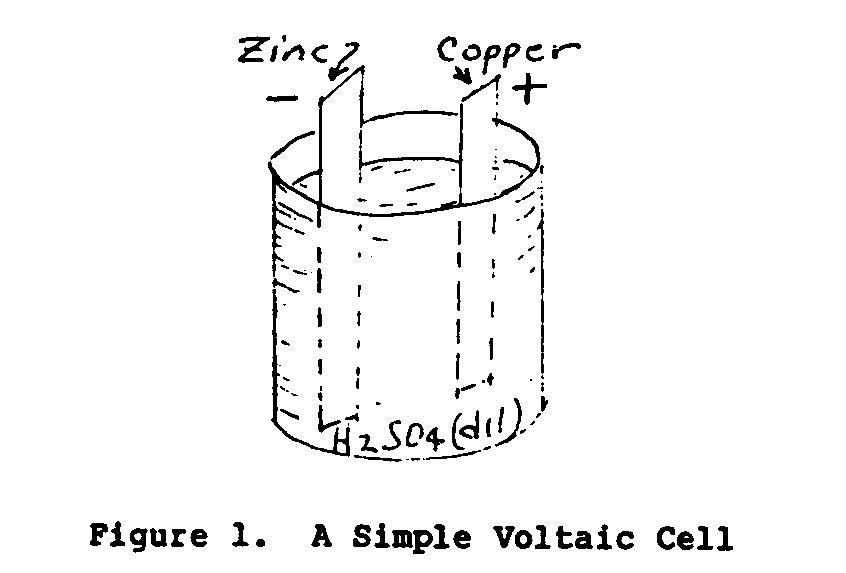
Se llaman los conductores sólidos de la célula los electrodos y el
el líquido dirigiendo el electrólito.
que UNA célula consiste en dos electrodos
y una batería A de electrolyte. consiste en uno o más
cells. El voltaje de la célula depende en el material del
los electrodos y el electrólito.
El rendimiento de la corriente eléctrica y
el poder de la célula es dependiente en las dimensiones del plato y
el peso del material del electrodo.
Hay dos tipos generales de baterías en el uso hoy: el primero
tipo o " pila seca " y el almacenamiento secundario battery. UN
la batería primaria produce una corriente por el acción de la descarga cuando uno
de los electrodos de la célula se descompone durante el uso.
Este tipo
de célula usar de nuevo recargando no pueden restaurarse y el
la célula entera debe desecharse cuando no es ningún active. Secondary más largo
las células, por otro lado, son químicamente reversibles y lata
se cobre y descargó durante muchos ciclos de funcionamiento antes
reemplazándose.
En la célula de voltaje simple mostrada en Figura 2, cuando dos disímil
ub2x3.gif (486x486)
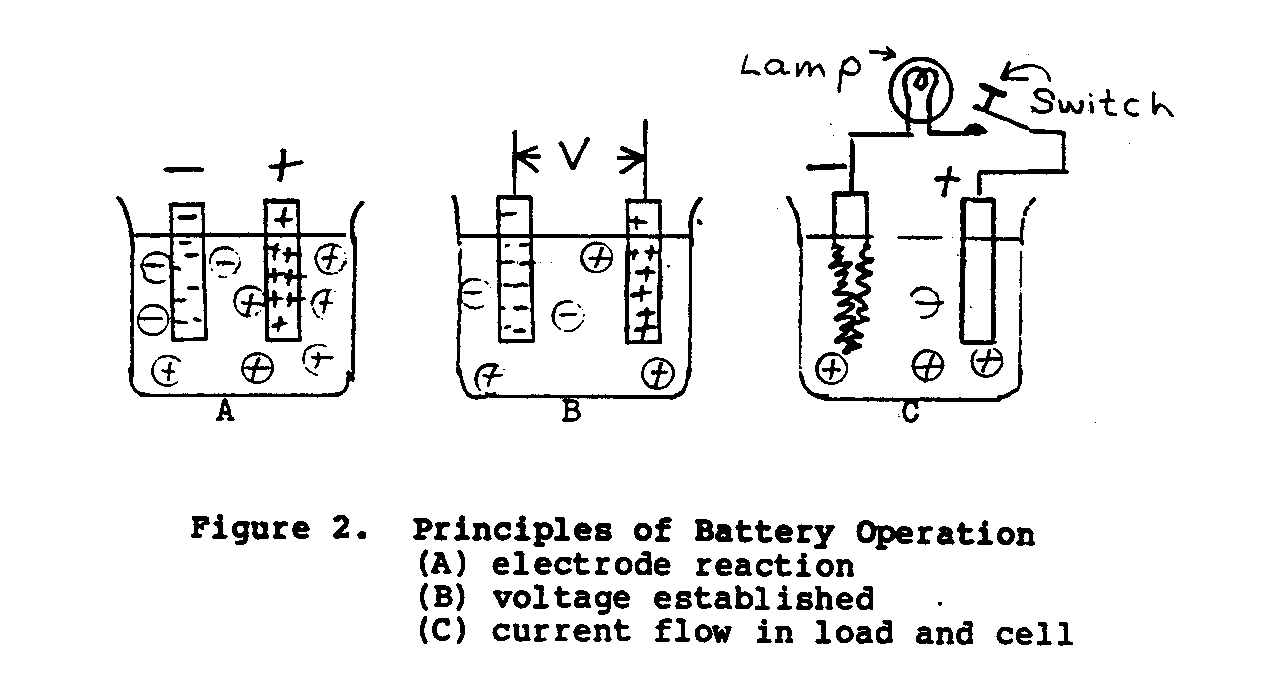
metales, cinc y cobre, están suspendidos en un electrólito de
diluya el ácido sulfúrico, un potencial de approxiamtely 1.10 voltios
exista entre los electrodos.
que El electrodo de cinc será
negativo y el electrodo cobrizo será positivo.
Cuando el
cambie en el circuito de carga externo está cerrado, un testamento actual,
fluya a través de la carga (el dispositivo absorbente de energía) y batería en
el acuerdo a la Ley de Ohm. (*) Como la corriente de carga continúa fluyendo,
el hidrógeno como las burbujas aparecerá y cubrirá la hoja de cobre, y
la hoja de cinc disolverá gradualmente.
La desventaja principal
con esta célula es que las burbujas de gas aumentan el interior
la resistencia de la célula, causando el rendimiento actual para disminuir.
----------------------
(*) La corriente directa que fluye en un circuito eléctrico es directamente
proporcional al voltaje aplicado al circuito.
La constante
de proporcionalidad R, llamó la resistencia eléctrica, se da
por el V de la ecuación = RI en que " el V " es el voltaje aplicado y
Yo " soy la corriente.
II. LAS VARIACIONES DE TECNOLOGÍA
LAS BATERÍAS PRIMARIAS
Varios tipos diferentes de primero-tipo mojaron se desarrollaron las células
y usó en los Estados Unidos.
Most notable entre éstos era el
la célula de gravedad, la célula de óxido de cáustico-cobre, los aire-despolarizamos,
la célula, y la célula de Lelanche.
Cada célula tenía su propio operando
las características, y las capacidades actuales fueron de menos de uno
el amperio (el amperio) para la célula de Lelanche a varios cientos amperios para
la célula de óxido de cáustico-cobre.
que El Office del Poste británico desarrolló
una célula húmeda conocido como la célula del Daniel que ofreció varios
los rasgos que opera excelentes.
Había dos dificultades principales con la célula del primero-tipo
la construcción, la deterioración por el acción local y polarización de la célula.
El acción local es un acción químico interior inherente a
las baterías; la vida de la célula se disminuye gradualmente incluso
aunque ninguna carga se conecta a sus términos.
que el acción Local es
definido como la descarga de material activo de cualquier plato debido
a un poco de impureza en el electrólito o material del plato.
Esto
el acción causa la formación de células puestas en cortocircuito que causan
el metal para deteriorar.
La polarización celular se causa por burbujas de hidrógeno que se depositan
en el cátodo cuando los flujos de corriente a través de la célula.
que Esto baja
la tensión en los bordes y aumentos la resistencia interna del
battery. los Varios métodos por neutralizar este efecto polarizante
se usó, o por químico o la construcción mecánica que
llevado al desarrollo de la célula aire-despolarizada.
En la célula aire-despolarizada, el electrodo era hecho de un favorablemente
la forma absorbente de carbono y estaba suspendido sobre el electrólito
level. desde que el electrodo de carbón no se sumergió en el electrólito
la solución, la polarización de la célula fue prevenida.
En
el funcionamiento, el cerco de oxígeno la superficie porosa del carbono
el electrodo combina con el hidrógeno evolucionado a la superficie de
el electrodo de carbón y electrólito.
que el ventilación Bueno fue requerido
para mantener un reabastecimiento por aire satisfactorio para el funcionamiento.
El
La Edison carbono célula y la batería de Carbonaire eran representativas
del tipo aire-despolarizado.
Wet que las células del primero-tipo tienen grandemente
se reemplazado por la batería de almacenamiento de secundario-tipo.
La pila seca del día " moderna " que se desarrolló por Georges
Lelanche en 1868, es una modificación del Lelanche viejo mojó la célula.
La diferencia es eso sólo agua suficiente se agrega al
el electrólito para humedecer un forro absorbente.
La pila seca moderna
es principalmente los el más ampliamente usamos de todas las baterías primarias hoy
debido a su cost bajo, la actuación fiable, y extendido
las availability. pila seca baterías son hecho en las valuaciones de 1.5, 3,
6, 7.5, 9, 22.5, 45, 67, y 90 voltios.
El tipo más común de construcción para una pila seca se muestra en
Figure 3.
ub3x4.gif (486x486)
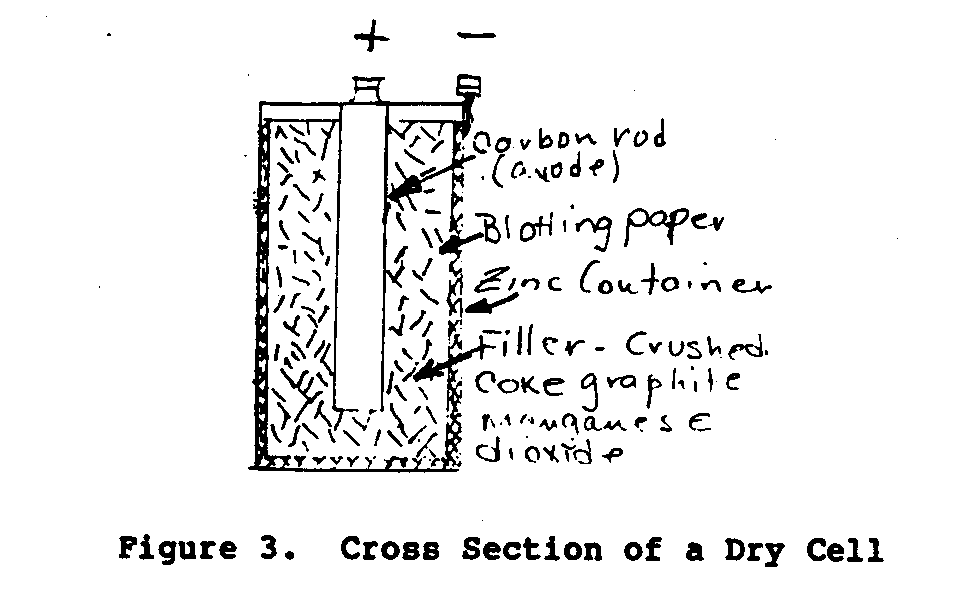
La célula en la Figura 3 usos una vara del carbono para el ánodo o positivo
el término y un recipiente de cinc externo (el caso) para el negativo
terminal. El caso de cinc tiene un forro interno de papel absorbente
material que es saturado con el electrólito.
El espacio
entre los electrodos está lleno con una mezcla de cok aplastado,
la mena de manganeso, y grafito.
El Manganeso de se agrega como un depolarizer.
El electrólito es salammonic y cloruro de zinc.
El
la cima del caso se sella con un mastique para tapar y el cinc
el recipiente es adjunto en un recipiente del papel.
El voltaje de un nuevo
la pila seca es 1.4 a 1.6 voltios.
Las baterías de la pila seca entran en tres clases generales: (1) la linterna eléctrica
las baterías normalmente 1-1/4 pulgada en el diámetro y 2-1/2 pulgadas
alto con una capacidad actual de aproximadamente 3 amperio-horas; (2) el tamaño grande
las células, más normalmente llamado el Número 6 pila seca, aproximadamente,
2-1/2 pulgadas en el diámetro y 6 pulgadas alto con un
la valuación actual de aproximadamente 30 amperio-horas; y (3) el " trabajo pesado "
y el voltaje alto teclea que podría ser una célula o una combinación
de células, usó en el servicio industrial con las capacidades actuales de
50 amperio-horas o greater. La capacidad de la amperio-hora es el rate de
descargue una batería puede mantener para un periodo dado de tiempo,
normalmente ocho hours. por ejemplo, una 30 batería de rated de amperio-hora
normalmente pueda proporcionar aproximadamente 3-1/2 amperios durante ocho horas.
Como ordinariamente
usado, sin embargo, las pilas seca proporcionan menos de su valuación.
La duración de almacenado está limitada por el acción local y por esa razón
algunos fabricantes estampan una fecha de servicio adelante el revestimiento exterior de
cada cell. el acción Local causa la deterioración eventual del
la batería, y más atrás aproximadamente un o dos almacenamiento de los años, la batería,
se vuelve useless. desde que el electrodo de cinc forma la parte del exterior
la pared, su destrucción gradual debilita la estructura celular, y como
las figuras del gas hidrógeno desarrolladas a la presión interior en campana, puede
la ruptura y cuenta sus volúmenes corrosivos.
Por esta razón, equipo
nunca debe guardarse con las pilas seca encima de los periodo largos de
las pilas seca de time. no requieren ningún mantenimiento y cuando ellos ningún más largo
opere se desecha y reemplazó.
Un más reciente tipo de pila seca desarrollado es el Ruben o Mercurio
la célula (Figura 4) . por que Esta célula se desarrolló durante el Segunda Guerra Mundial
ub4x6.gif (600x600)
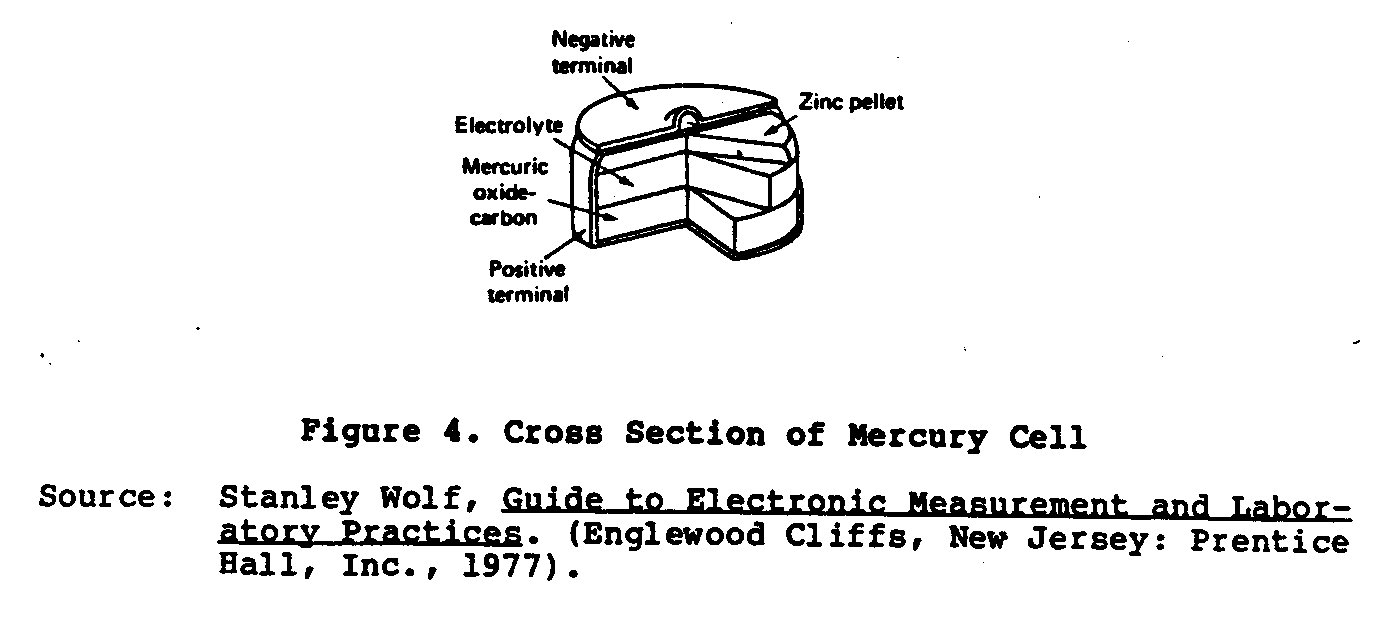
Los Laboratorios de Ruben y P.R. La Compañía de Mallory por operar pequeño
equipo electrónico que requiere el poder actual alto.
que Esta célula es
hecho en dos formas: el " ánodo " del rollo y el " botón teclean. " El
el ánodo se amalgama cinc y el cátodo es un óxido mercúrico
el material despolarizado mezcló con grafito.
El electrólito es un
la solución de hidróxido de potasio (el KOH) conteniendo el zincate de potasio.
Estas células son lejos superiores al Lelanche pila seca deber
a su tamaño compacto, la característica de voltaje llana, y muy mucho tiempo
el estante life. El voltaje de ningún-carga de estas células es 1.34 voltios.
Varios desarrollos avanzados han sido hecho en las baterías pequeñas,
primero y células del secundario-tipo que incluyen el
el magnesio, alcalino, plata-cinc, y litio.
La Mesa de 1 listas el
ubxtab1.gif (600x600)

las características y aplicaciones de estas células.
LAS BATERÍAS DEL ALMACENAMIENTO SECUNDARIAS
Desde 1965, allí se ha renovado el interés usando el almacenamiento
las baterías en el poder systems. que Esto es porque el consumo máximo moderno
involucra demandas de carga muy desiguales y la carga máxima creciente
demands. Cuando un system debe entregar más poder (el aumento en la carga
la demanda), el proveedor puede encontrarse la demanda por cualquiera cambiando un
generador adicional hacia el system o cambiando un cobró
el banco de la batería hacia el line. El último requiere un muy menor
la inversión.
El reavivamiento de baterías como las unidades de system de poder tiene principalmente
empezado con el systems independiente pequeño como el viento - o agua-manejado
generators. En el tal systems, las baterías del almacenamiento realizan
dos functions. First importantes, durante los periodo de demanda de carga baja,
la batería del system puede guardar mucha de la energía generada,
qué se perdería por otra parte al system.
Second, la energía,
guardado durante el periodo debajo del máximo está disponible durante tiempos de
la carga máxima demand. La importancia del último puede ilustrarse
con lo siguiente ejemplo cuantitativo: Suponga el
la capacidad de la batería tiene un rate de poder de descarga igualar a la mitad
de la capacidad de poder de generador ([P.sub.B] = 0.5 [P.sub.G]) . Esto significa eso
bajo las condiciones normales, durante los periodo de demanda de carga alta, el
el generador-batería la lata combinatoria durante varias horas sirve una carga
de a a 1.5 veces eso que el generador solo podría servir.
Otra razón para el interés aumentado en el almacenamiento secundario
las baterías son la necesidad por el poder del apoyo por algunos del más nuevo
technology. por ejemplo, más más de las computadoras modernas involucre alguna forma
de " almacenamiento volátil " de información, eso es, la información es
perdió si el poder es removed. para guardar contra esta posibilidad, muchos,
los systems de computación usan " el systems de poder continuo ", basado en
las baterías del almacenamiento, proporcionar la corriente eléctrica a la computadora,
el equipo cuando el poder comercial está perdido.
La batería del almacenamiento, construida con las células húmedas secundarias, es
similar en el acción a una célula primaria, exceptúe los acción químicos
involucrado es prácticamente completamente reversible.
Once que la célula es
descargado, actual de una fuente externa, atravesó el
la célula en la dirección opuesta, restaurará substancialmente el
la batería a su original cobró la condición.
Hay tres tipos de baterías del almacenamiento actualmente disponible:
(1) el tipo del llevar-ácido; (2) el ferro-níquel o la batería alcalina
(La célula de Edison); y (3) el níquel-cadmio o álcali-tipo (Nicad).
Las Baterías del llevar-ácido
La batería del llevar-ácido es el tipo ampliamente usado de batería
hoy debido a su cost bajo, fiabilidad, la actuación buena,
las características, y la aplicación ancha.
Esta batería es manufacturada
en muchos tamaños y capacidades la 1 amperio-hora comprendido entre a a
varios mil valuación de las amperio-horas. (*)
El almacenamiento celular usa la primacía de la esponja reactiva para el negativo
el electrodo (Pb), lleve el dióxido para el electrodo positivo (Pb0),
y diluye el ácido sulfúrico para el electrólito.
El electrodo
los materiales tienen la fuerza estructural pequeña y deben apoyarse
en platos o grids. La reja del placa de batería tiene dos funciones:
primero, apoya el material del plato activo; y segundo,
sirve como un conductor conectar el término del plato a todos
las partes del material activo.
Lleve los placas de una batería son divididos en dos tipos, el
Plante (formó) y el Faure (pegó), así desplegado en Figura 5. En
ub5x9.gif (600x600)
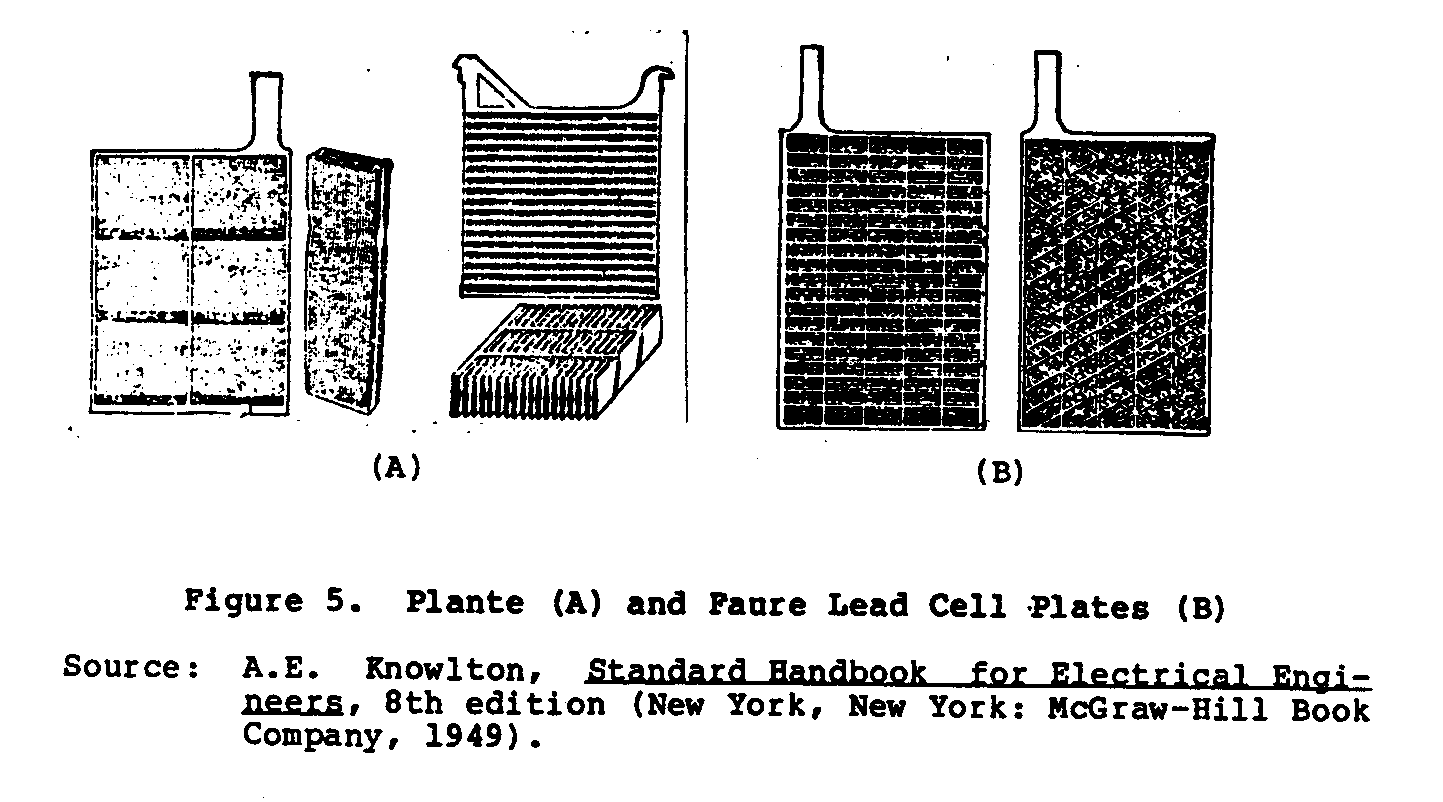
el Plante-tipo de construcción que el material activo es eléctricamente
formado de pura primacía por un proceso electroquímico del
la primacía metálica de la reja de apoyo.
En el Faure-tipo el
el material activo se aplica a la reja de apoyo en la forma de
un follwed de pasta por una escena, secado, y funcionamiento de la creación.
Figure 5 muestras el Plante (UN) y Faure (el B) lleve plates. celular El
se soldan las asambleas celulares juntos para formar positivo y negativo
grupos que se entrelazan para hacer a juntos el completo
batería que se ponen los Separadores de cell. entre los electrodos,
y el elemento completo se pone en un recipiente y sealed. El
el uso de platos grandes con cerca límites del espacio la resistencia interna
de la batería a un nivel bajo.
Figure 6 muestras un chaqué
ub6x9.gif (600x600)
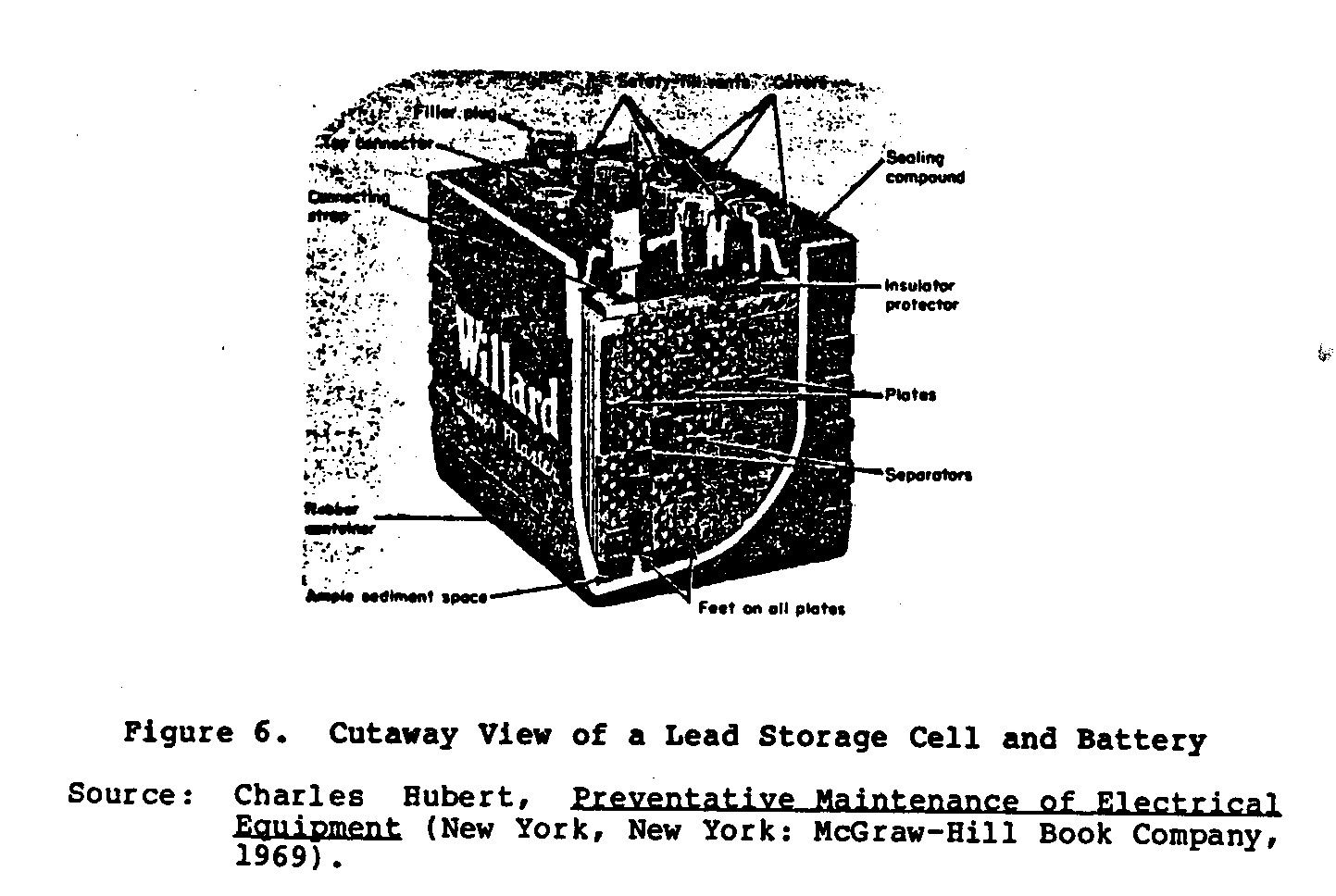
la vista de la célula de almacenamiento de primacía.
Durante la descarga el material de la batería de ambos platos es reconstruido
en la primacía sulfate. La cantidad de sulfato de plomo formó los platos del onthe
y la cantidad de ácido perdió del electrólito es en exacto
proporcione al rate de descarga.
Las tomas de acción inversas
el lugar cuando la célula se cobra.
que las reacciones química Celulares son
representado por lo siguiente ecuación; sin embargo, esto es un
la forma simplificada como el acción real es mucho más complicada.
-----------------------
(*) La valuación de amperio-hora de batería es normalmente basada en una descarga de la 8-hora
el rate.
Al placa positiva:
PB[O.SUB.2] + HS[O.SUB.4][SUP. -] + [3H.SUP.+] + [2E.SUP. -] (*)-----> PB[SO.SUB.4] + 2[H.SUB.2]O
Al placa negativa:
Pb + HS[O.sub.4][sup. -]-----> Pb[SO.sub.4] + [H.sup.+] + [2e.sup. -]
La reacción celular combinada para los dos la descarga y el cargo se expresa
por lo siguiente ecuación:
descargan
------------->
Pb[O.sub.2] + Pb + 2[H.sub.2] S[O.sub.4] <= == == = 2Pb[SO.sub.4] + 2[H.sub.2]O + la energía eléctrica
sulfúrico
el plate del plate los platos de ácidos
<-------------
cobran
En la descarga el ácido separa del electrólito y formas un
la combinación química con los platos, cambiándolo al sulfato de plomo.
Cuando la descarga continúa, el ácido adicional es arrastrado del
el electrólito hasta que actual dejará dado fluir.
El agua, formó
por la pérdida de ácido a los platos, baja el permaneciendo específico
la gravedad (* *) del electrólito.
En la práctica común, la descarga es
siempre detenido antes de los platos tiene el sulfated completamente, porque
una vez completamente el sulfated, la condición de la batería no puede convertirse
atrás al material activo en el cargo.
En el cargo el acción inverso
las tomas ponen: el ácido en los platos del sulfated se maneja atrasado en
el electrólito, y el S[O.sub.4] combina con el hidrógeno en el agua
para formar el ácido sulfúrico adicional ([H.sub.2][SO.sub.4]).
El electrólito para las células del llevar-ácido es diluir acid. sulfúrico Para un
batería totalmente cobrada a que el peso especifico varía de 1.200
1.30 y cuando descargó 1.150 (el agua pura mide 1.00) . El
el peso especifico es moderado por un hidrómetro del jeringa-tipo como
mostrado en Figura 7, y los valor son temperatura corregida.
ub7x11.gif (600x600)

------------------------
(*) El símbolo e - las posiciones para los electrones.
(* *) El peso especifico se define como la proporción en peso de un dado
el volumen de una substancia a un volumen igual de agua pura.
El voltaje de una célula de primacía está aproximadamente 2.10 voltios en ninguna carga
pero es superior al cobrarse.
el voltaje Normal en el cargo es
2.15 voltios y cuando los acercamientos celulares el cargo lleno este valor
rápidamente los aumentos a entre 2.5 y 2.6 voltios.
Este intervalo posterior
de cargo está conocido como el " periodo " del gassing.
Gassing del
el electrólito a cuando quiera durante cobrar debe evitarse como el
el rate de cargo también es totalmente high. Como un alcances celulares su examen final
la condición cobrada, una corriente alta no es aconsejable como este exceso
la corriente descompone el agua en el electrólito que se maneja
fuera de en la forma de gas.
La batería del llevar-ácido tiene varias desventajas:
(1) las células son
la temperatura sensible y pierde el poder en las temperaturas frías; (2)
los platos celulares tienden abrochar y torcer adelante sostuvo, la corriente alta
repare, y (3) el cuidado especial debe observarse cuando una batería es
no usado para los periodo largos, por otra parte las células legan el sulfato.
Las Baterías del ferro-níquel
El ferro-níquel o la batería alcalina fueron desarrolladas para superar el
las desventajas inherentes de la célula del llevar-plato.
es un radical
la salida de él en construcción y funcionamiento.
En el
Estados Unidos que esta batería está conocido como la " célula de Edison, " nombró
más atrás su inventor Thomas À. Edison.
Figure 8 muestras la construcción
ub8x13.gif (600x600)
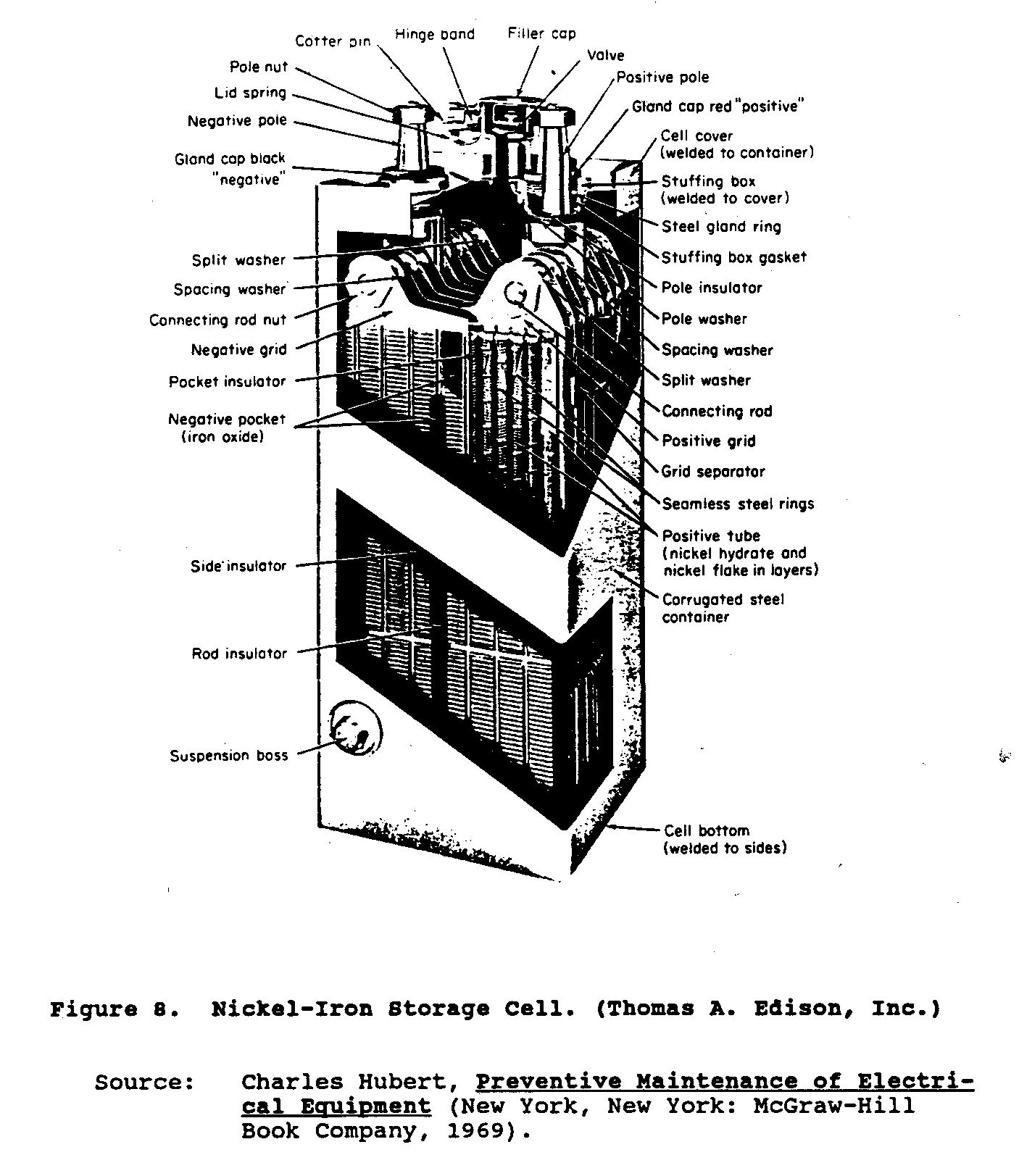
de un cell. típico El placa positiva consiste en acero
tubos que contienen hidrato de níquel y níquel agregaron en el alternante
layers. El placa negativa se forma de cajas de acero llanas o
bolsillos que son performado y condensaron con los gránulos del óxido de hierro.
Las rejas de Sheet-steel apoyan estos tubos y bolsillos que son
echado el cerrojo a para formar la Célula de groups. celular positiva y negativa juntos
los términos y el recipiente de acero son niquelados.
los separadores Todo
y las partes aislantes son hecho de caucho.
Los usos celulares un
el electrólito de 21 solución percentual de hidróxido de potasio que contiene un
la cantidad pequeña de hidrato del litio.
La química de esta célula es bastante complicada, y el químico
reacción que ocurre dentro de la célula es completamente diferente de
el de la primacía cell. que El electrólito actúa meramente como un dirigir
el medio y no entra en la combinación con cualquiera del
el material del plato activo durante el funcionamiento.
Su peso especifico
los restos prácticamente constante durante el ciclo completo de cargo
y discharge. Condition de cargo de la batería o descarga es determinado
por un voltímetro que lee y no por el peso especifico de
el electrolyte. que La reacción del vaso de la batería alcalina es:
descargan
------------------>
[Fe.sub.2] + 2NiOOH + el KOH + 2[H.sub.2]O-------> [Fe.sub.2][(OH) .sub.2] + 2Ni[(OH) .sub.2] + el KOH + eléctrico
<------
<----------------- la energía de
CHARGE
El voltaje de cada célula es aproximadamente 1.50 voltios adelante abra
el circuito, pero es superior en el cargo y baja bajo las condiciones de carga.
Estas baterías se dan una valuación de capacidad de amperio-hora basada
en su rate de descarga a a la tensión final de 1.00 por
cell. Algunas valuaciones actuales son basadas en una 5-1/2-hora continuo
descargue el rate, mientras otros son basados en un rate de la 3-1/2-hora.
Al contrario de la batería del llevar-célula, no hay voltaje mínimo debajo
qué este tipo de célula no puede descargarse.
En el hecho, esta célula
puede descargarse poner a cero los voltios, puesto en cortocircuito en sus términos,
y salió en esta condición para un periodo indefinido.
Esto
es el método por que una batería alcalina se pone en el almacenamiento.
También, esta célula puede sobrecargarse accidentalmente, cobró en el
la dirección mala, y momentáneamente puso en cortocircuito sin el daño.
Las baterías alcalinas no son dañadas helando y un electrólito
con un peso especifico de 1.200 a las 15.5[degrees]C (60[degrees]F) el sólido de las heladas
a las -66[degrees]C (-87[degrees]F).
que El electrólito de esta célula deteriora gradualmente
durante el uso y debe cambiarse en el futuro.
Las ventajas principales de la célula del ferro-níquel son: (1) es
sumamente la luz y debiendo muy bien a su construcción de acero; (2)
ofrece una vida indefinidamente larga; y (3) supera el
el problema del sulfating celular de la batería del llevar-ácido.
El jefe
la desventaja es su alto primero el cost y la resistencia interna alta.
Las baterías de níquel-cadmio
Níquel-cadmio o baterías de Nicad, una relativamente nueva suma a
las células del almacenamiento, se desarrolló en Europa.
que Estas baterías consisten
de asambleas entrelazadas de positivo y montado de los placas negativa
en un recipiente de acero sellado.
El material activo positivo, níquel,
el hidróxido, y el material activo negativo, el óxido del cadmio, es
encajonado en los bolsillos de acero idénticos, finamente perforados.
Los platos
es hecho a de filas de estos bolsillos que se rizan y
formado en acero frames. Positive y asambleas del placa negativa
es juntos empernado a las barras de autobús de acero pesadas.
Los grupos de discos de son
entrelazado y separó por las varas plásticas delgadas.
La célula eléctrico
los términos y caso son niquelados.
El electrólito es un
la solución de especialmente hidróxido de potasio purificado (el hidróxido de potasio)
disuelto en el agua destilada.
Figure 9 muestras una vista transversal
ub9x15.gif (600x600)
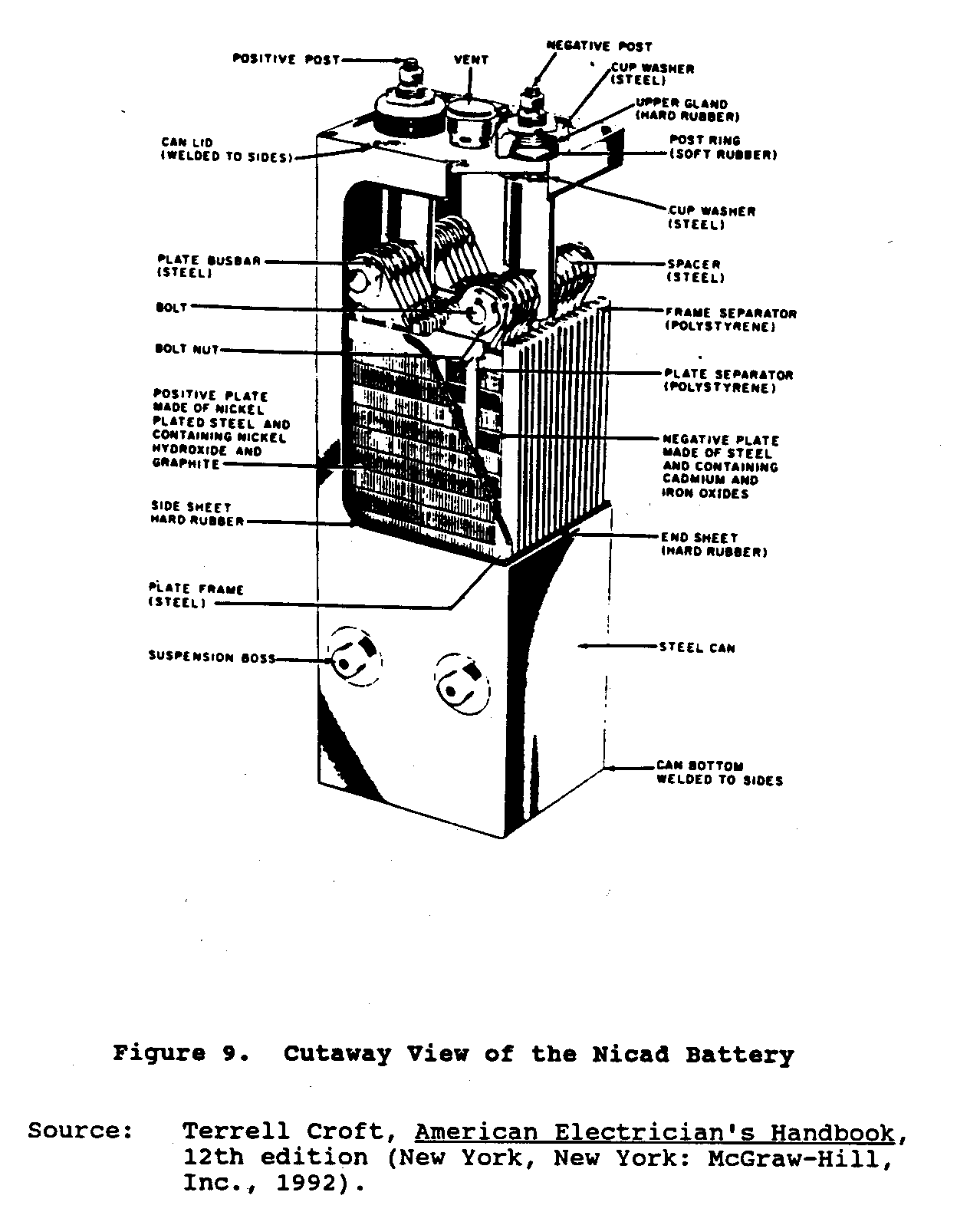
de la batería de Nicad.
La reacción celular simplificada es:
cobran
<-------------------
Cd + 2NIOOH + el KOH + 2[H.sub.2]O------> Cd[(OH) .sub.2] + 2Ni[(OH) .sub.2] + el KOH + eléctrico
<------la energía de
-------------------->
descargan
Durante cargo o descarga de la célula, hay prácticamente no
cambie en el peso especifico del electrólito.
Like el
La célula de Edison, la sola función del electrólito es actuar como un
conductor para el traslado de iones de hidrógeno de un electrodo a
el other. La valuación de voltaje de cada célula es 1.20 voltios adelante abra
el circuito; cuando conectó a una carga externa, este voltaje permanece
justamente constante a a aproximadamente 90 por ciento de su rated
capacity. La valuación de la amperio-hora de las células de Nicad es basada en un
el voltaje de la descarga final de 1.10 voltios por la célula.
Edison Diferente
las células, las baterías de Nicad serán dañadas el encima de-descargando repetido
debajo de su valuación celular mínima de 1.10 voltios.
las baterías de Nicad
tenga un régimen de funcionamiento de temperatura de -51[degrees]C (-60[degrees]F) a 93[degrees]C
(200[degrees]F).
Las baterías de Nicad son vibración y susto la deuda resistente a su
la construcción de acero; el sostenimiento su cargo bien durante largo ocioso
los periodo; mantenga una fuente de voltaje constante durante la descarga; y
no se daña por la sobrecarga.
en que Estas baterías pueden montarse
cualquier posición en discharge. Como la célula de Edison, la batería de Nicad
tiene un alto primero el cost como comparado con la batería del llevar-ácido;
sin embargo, este cost alto se compensa por su vida más larga
span. UNA comparación de llevar-ácido, el alcalino, y las baterías de Nicad son
presentado en Mesa 2.
Mesa 2.
La comparación de Llevar-ácido, el Ferro-níquel,
y baterías de níquel-cadmio
Operating la Vida Celular
La Typical Temperatura la Energía de el Cargo de /
El Cell Rango la Densidad de Discharge Cost
TYPE VOLTAGE ([EL DEGREES]C) (WH (*) /KG) (CYCLES) ($/WH (*))
Llevar-Acid 2.0 20 a 30 37 1200-1500 .08
Níquel-Iron 1.2 2.2 a 46 29
Níquel-Cadmium 1.25 (-51) a 93 33
(* )Watt-horas
Los Procedimientos de Mantenimiento Generales para las Baterías del Almacenamiento
El mantenimiento apropiado es esencial para el servicio sin preocupaciones continuado
de almacenamiento batteries. Mientras la construcción celular es diferente
para los varios tipos, el mantenimiento es similar para todos los tipos
y consiste en lo siguiente procedimientos generales:
1.
Keep las células limpian y seco;
2.
Check el nivel de electrólito regularmente;
3.
Keep las baterías cobraron en todo momento; y
4.
Keep las impurezas de todos los tipos fuera de células cuando ellos quieren
tienen un efecto dañoso y en el futuro la ruina them. Never
usan cualquier herramienta o utensilios (los hidrómetros, los embudos, etc.)
que se ha usado para reparar otros electrólitos diferente
de eso requerido para esa batería específica,
sobre todo las herramientas usaron para las baterías del llevar-ácido.
5.
Refer a las recomendaciones de fabricantes y guarda un
el registro de mantenimiento escrito.
El electrólito de la célula del llevar-ácido nunca requiere el reemplazo
salvo la pérdida debido a los derramamientos accidentales.
However, en el Edison,
y células de Nicad hay una deterioración gradual de su electrólito,
qué debe reemplazarse en el futuro encima de la vida del
la batería.
BIBLIOGRAPHY/SUGGESTED READING LA LISTA
BAUMEISTER, T., EL ED. El Mark Norma Manual para los ingenieros mecánicos.
7 Edición. Nueva York, Nueva York,:
El Libro del McGraw-colina
La Compañía de , 1967.
CARR, C.C. El Electricista americano de destreza el Manual. 8 Edición.
Nueva York, Nueva York,:
La Compañía de Libro de McGraw-colina, 1961.
Fink y Batey. Norma Manual para los ingenieros eléctricos.
11
La Edición de . Nueva York, Nueva York,:
La Compañía de Libro de McGraw-colina, 1978.
Hubert, Charles I. Preventative el Mantenimiento de Equipo Eléctrico.
Nueva York, Nueva York,:
La Compañía de Libro de McGraw-colina, 1969.
Knowlton, A.E., Manual de la Norma para los ingenieros eléctricos.
8
La Edición de . Nueva York, Nueva York,:
La Compañía de Libro de McGraw-colina, 1949.
La Enciclopedia del McGraw-colina de ciencia y tecnología. 5 Edición.
Nueva York, Nueva York,:
La Compañía de Libro de McGraw-colina, 1982.
El timbre y Principios de Bush. de Ingeniería Eléctrica.
3 Edición.
Nueva York, Nueva York,:
Wiley e Hijos, Inc., 1946.
El lobo, Stanley. Guide a la Medida Electrónica y Laboratorio,
Practices.
Los Precipicios de Englewood, New Jersey,: El Vestíbulo de Prentice,
Inc., 1977.
== == == == == == == == == == == == == == == == == == == ==
== == == == == == == == == == == == == == == == == == == ==

